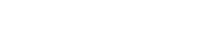Energie uit water - Hoe zuurstof en waterstof te produceren op de maan
In deze set van drie activiteiten leren de leerlingen over elektrochemie.
In de eerste activiteit zullen zij een voltaïsche paal bouwen - een eenvoudige batterij. Deze uitvinding betekende het begin van de elektrochemie.
De leerlingen zullen vervolgens elektrolyse bestuderen. Elektrolyse gebruikt elektrische stroom om water te splitsen in zijn componenten: waterstof en zuurstof. Deze producten kunnen worden gebruikt als drijfgas voor ruimtevaartuigen en/of om zuurstof te leveren voor de bemanning.
In de laatste activiteit onderzoeken en gebruiken de leerlingen een brandstofcel.
Leerdoelen
Leeftijdscategorie:
14 - 16 jaar oud
Tijd
Bereiding: 1 uur
Les: 2 uur
Les: 2 uur
Hulpbron beschikbaar in:
Activiteit 1: Bouw je eigen batterij
In deze activiteit bouwen de leerlingen een voltaïsche stapel - een eenvoudige batterij - van metalen platen, vaatdoek en azijn. Een voltaïsche heipaal maakt gebruik van een spontane chemische reactie om elektriciteit te maken.

Uitrusting
Activiteit 2: Elektrolyse
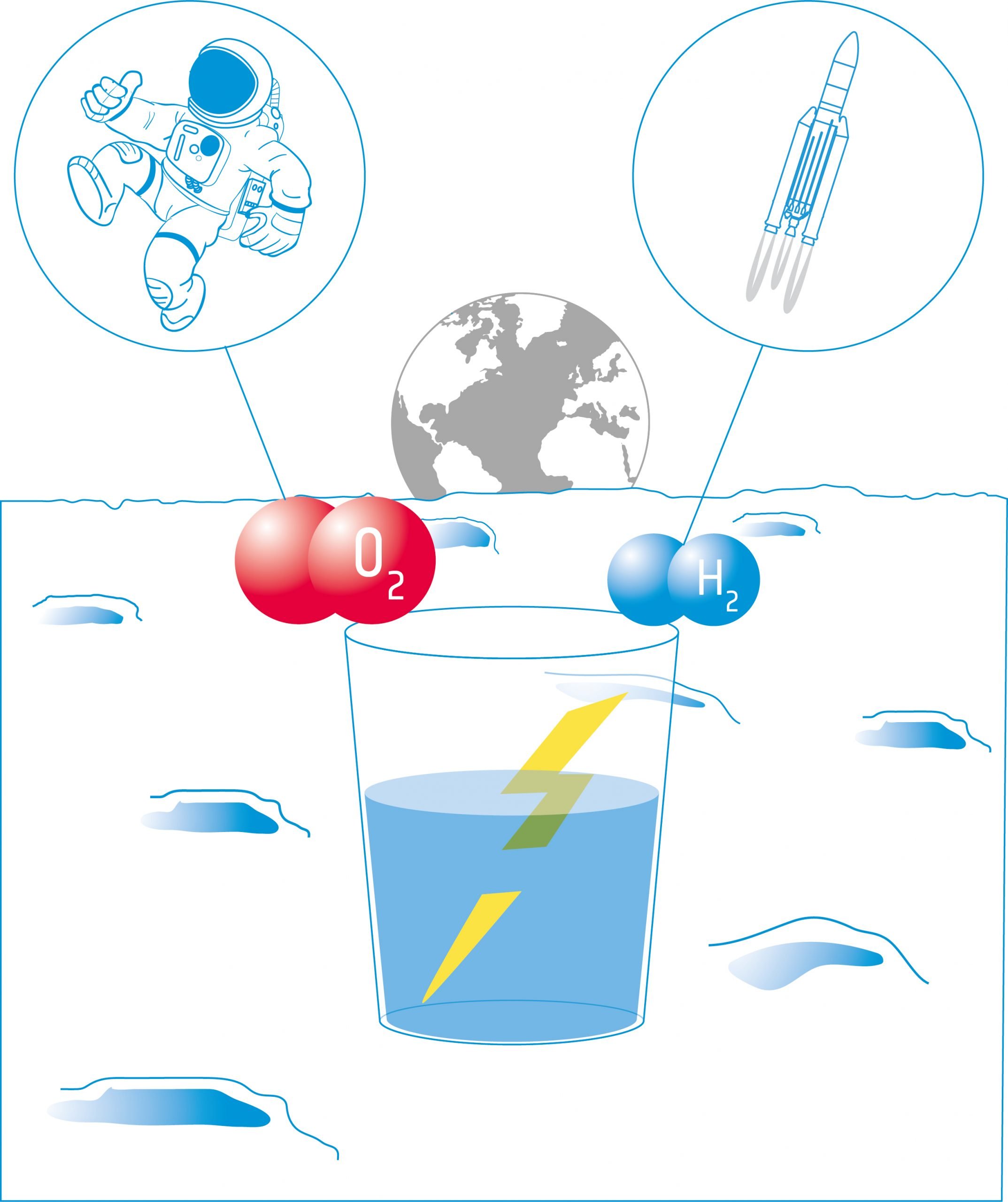
In deze activiteit bouwen de leerlingen een elektrolyseapparaat: een apparaat dat met behulp van twee elektroden een elektrische stroom in een vloeistof brengt. Ze zullen het apparaat gebruiken voor elektrolyse van water en ontdekken dat het mogelijk is water te splitsen in zijn componenten: zuurstof en waterstof.
Uitrusting
Activiteit 3: Brandstofcel
In deze activiteit gebruiken de leerlingen de producten van waterelektrolyse (H2 en O2) in een brandstofcel. Ze zullen onderzoeken hoe brandstofcellen elektriciteit en warmte produceren uit een chemische reactie. De leerlingen zullen de mogelijkheden en beperkingen van brandstofcellen voor de verkenning van de maan in overweging nemen.
Uitrusting
Wist je dat?
Elektrolyse van water is de belangrijkste methode om zuurstof te produceren aan boord van het internationale ruimtestation (ISS). Water wordt opgevangen uit urine, afvalwater en condensatie en in het Oxygen Generation System (OGS) gesplitst in zuurstof en waterstof.
De zonnepanelen van het station zijn zo groot als een voetbalveld en leveren de energie. Een soortgelijk systeem zou op de maan kunnen worden gebruikt.
De zonnepanelen van het station zijn zo groot als een voetbalveld en leveren de energie. Een soortgelijk systeem zou op de maan kunnen worden gebruikt.

Het ISS in een baan om de aarde
Sleutelwoorden:

Maanschuilplaats - Onderzoek naar verschillende schuilplaatsen op aarde en in de ruimte
Korte beschrijving: In deze reeks activiteiten analyseren de leerlingen het belang van beschutting voor bescherming op aarde en in de ruimte. De leerlingen vergelijken

Tekenen van een vallende ster - Kometen, meteoren en kraters in het zonnestelsel
Korte beschrijving: Voor veel oude beschavingen was het verhaal van een vallende ster een voorteken van wat komen ging. In deze reeks activiteiten kunnen leerlingen
Kan leven overleven in vreemde omgevingen? - Het definiëren van omgevingen die geschikt zijn voor leven
Korte beschrijving: In deze activiteit zullen de leerlingen nagaan of het leven dat in extreme omgevingen op aarde wordt aangetroffen, elders in het zonnestelsel zou kunnen overleven. De leerlingen zullen