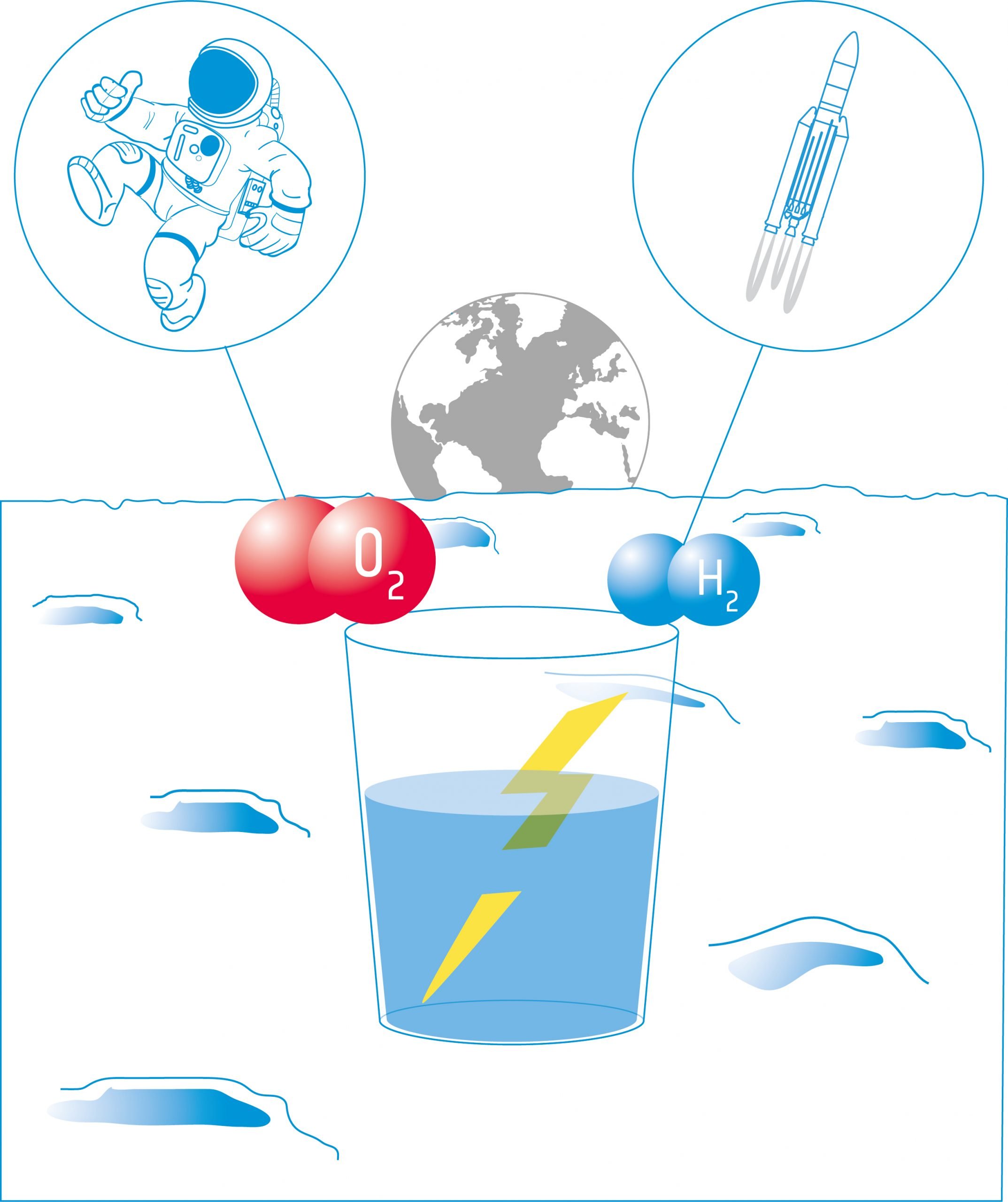
Energiát a vízből - Hogyan állítsunk elő oxigént és hidrogént a Holdon?
Ebben a három tevékenységből álló sorozatban a diákok megismerkednek az elektrokémiával.
Az első tevékenység során egy voltaikus cölöpöt - egy egyszerű akkumulátort - építenek. Ez a találmány jelentette az elektrokémia kezdetét.
A diákok ezután az elektrolízist tanulmányozzák. Az elektrolízis elektromos áramot használ a víz alkotóelemeire: hidrogénre és oxigénre való szétválasztásához. Ezek a termékek felhasználhatók űrhajók hajtóanyagaként és/vagy a legénység ellátásához szükséges oxigén biztosítására.
Az utolsó tevékenység során a tanulók megvizsgálnak és használnak egy tüzelőanyag-cellát.
Tanulási célok
Korosztály:
14 - 16 éves korig
Idő
Előkészítés: 1 óra
Lecke: 2 óra
Lecke: 2 óra
Erőforrás elérhető a következőkben:
1. tevékenység: Építsd meg a saját akkumulátorodat
Ebben a tevékenységben a tanulók fémlemezekből, mosogatórongyból és ecetből egy voltaikus halmot - egy egyszerű akkumulátort - építenek. A voltaikus halom spontán kémiai reakciót használ elektromosság előállítására.

Berendezések
Tevékenység 2: Elektrolízis
Ebben a tevékenységben a tanulók egy elektrolízert építenek: egy olyan eszközt, amely két elektróda segítségével elektromos áramot vezet egy folyadékba. A készüléket víz elektrolízisére fogják használni, és felfedezik, hogy a vizet szét lehet bontani alkotóelemeire: oxigénre és hidrogénre.
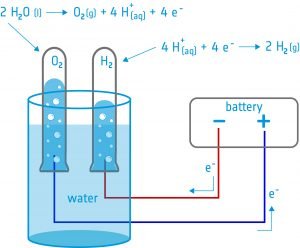
Berendezések
3. tevékenység: Üzemanyagcella
Ebben a tevékenységben a tanulók a víz elektrolízisének termékeit (H2 és O2) egy üzemanyagcellában. Megvizsgálják, hogy az üzemanyagcellák hogyan termelnek áramot és hőt egy kémiai reakcióból. A tanulók mérlegelik az üzemanyagcellák lehetőségeit és korlátait a Hold felfedezésében.
Berendezések
Tudtad?
A Nemzetközi Űrállomás (ISS) fedélzetén a víz elektrolízise a fő módszer az oxigén előállítására. A vizet vizeletből, szennyvízből és kondenzvízből gyűjtik, majd az oxigéntermelő rendszerben (OGS) oxigénre és hidrogénre bontják.
Az állomás futballpálya méretű napelemtáblái jelentik az energiaforrást. Hasonló rendszert lehetne használni a Holdon is.
Az állomás futballpálya méretű napelemtáblái jelentik az energiaforrást. Hasonló rendszert lehetne használni a Holdon is.

Az ISS Föld körüli pályán
Kulcsszavak:
Energia a napfényből - Napenergiával az űrkutatás meghajtása
Rövid leírás: Ebben a feladatsorban a tanulók megismerkednek két olyan fogalommal, amelyek befolyásolják a napelemek tervezését az űrmissziókhoz: a fordított négyzetes törvényt

Leszállás a Holdon - Egy holdraszálló űrhajó tervezése és kivitelezése
Rövid leírás: A diákok egy leszállóegységet terveznek, terveznek és építenek, hogy biztosítsák a legénység túlélését (a

Hold alkotmány - Hogyan szerveződne egy jövőbeli holdi közösség?
Rövid leírás: Ebben a forrásban a tanulók megvitatják egy jövőbeli holdi település néhány szervezeti és társadalmi jellemzőjét, és kapcsolatba hozzák azt a saját