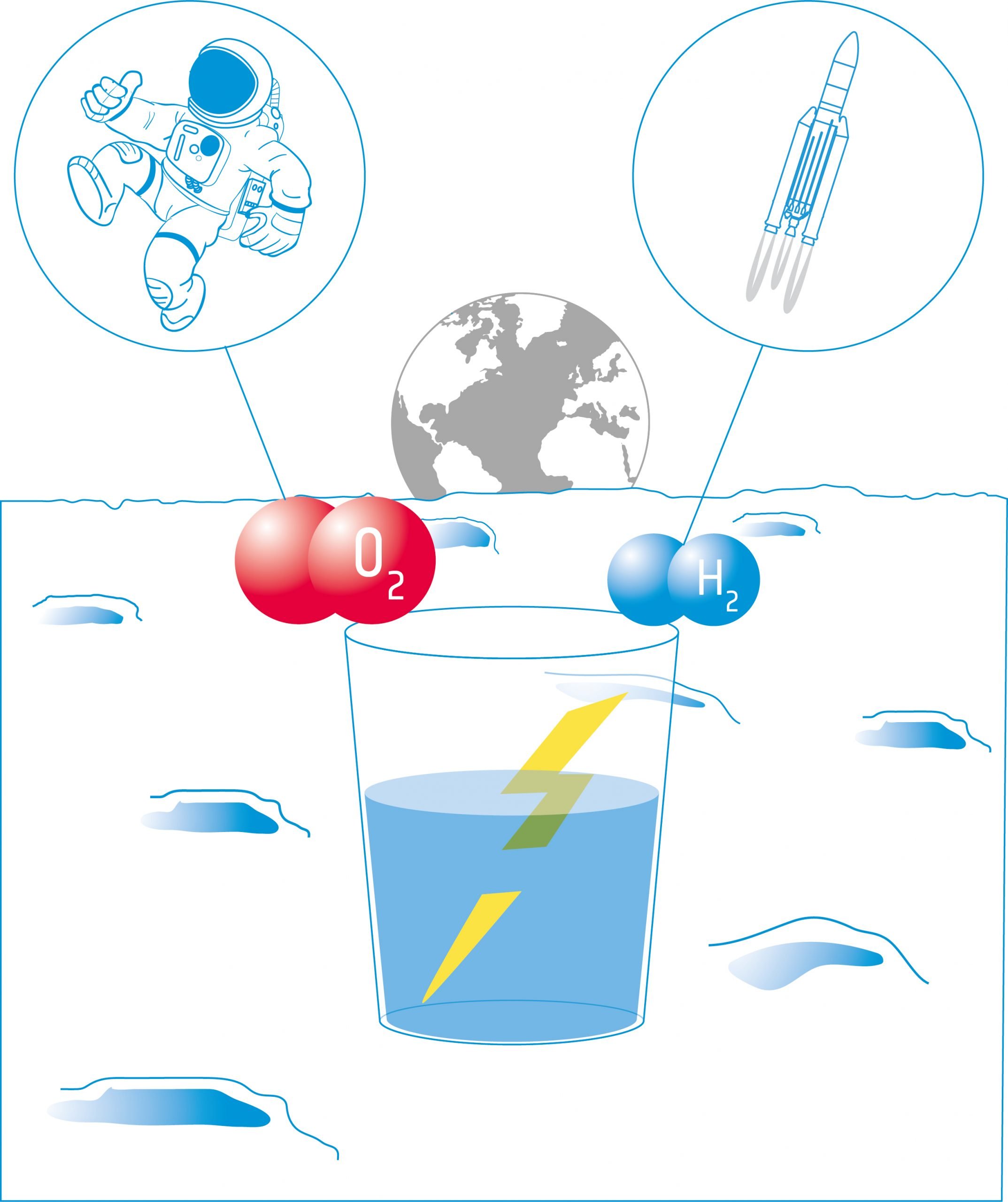
Energie din apă - Cum să producem oxigen și hidrogen pe Lună
În acest set de trei activități, elevii vor învăța despre electrochimie.
În cadrul primei activități, vor construi o pilă voltaică - o baterie simplă. Această invenție a marcat începutul electrochimiei.
Elevii vor studia apoi electroliza. Electroliza utilizează curentul electric pentru a descompune apa în componentele sale: hidrogen și oxigen. Aceste produse pot fi folosite ca propulsoare pentru navele spațiale și/sau pentru a furniza oxigen pentru a susține un echipaj.
În ultima activitate, elevii examinează și utilizează o celulă de combustibil.
Obiective de învățare
Interval de vârstă:
14 - 16 ani
Timp
Pregătirea: 1 oră
Lecție: 2 ore
Lecție: 2 ore
Resurse disponibile în:
Activitatea 1: Construiește-ți propria baterie
În cadrul acestei activități, elevii vor construi o pilă voltaică - o baterie simplă - din plăci de metal, cârpă de vase și oțet. O pilă voltaică folosește o reacție chimică spontană pentru a crea electricitate.

Echipament
Activitatea 2: Electroliza
În această activitate, elevii vor construi un electrolizator: un dispozitiv care introduce un curent electric într-un lichid cu ajutorul a doi electrozi. Ei vor folosi dispozitivul pentru electroliza apei și vor descoperi că este posibil să scindeze apa în componentele sale: oxigen și hidrogen.
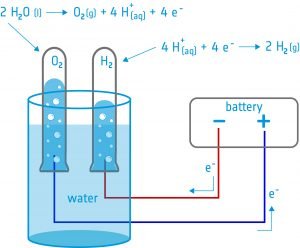
Echipament
Activitatea 3: Celula de combustibil
În această activitate, elevii vor folosi produsele electrolizei apei (H2 și O2) într-o celulă de combustibil. Aceștia vor studia modul în care pilele de combustie produc electricitate și căldură în urma unei reacții chimice. Elevii vor lua în considerare posibilitățile și limitele pilelor de combustie pentru explorarea Lunii.
Echipament
Știați că?
Electroliza apei este principala metodă de generare a oxigenului la bordul Stației Spațiale Internaționale (ISS). Apa este colectată din urină, ape reziduale și condensare și este împărțită în oxigen și hidrogen în sistemul de generare a oxigenului (OGS).
Sursa de energie este reprezentată de panourile solare ale stației, de mărimea unui teren de fotbal. Un sistem similar ar putea fi folosit pe Lună.
Sursa de energie este reprezentată de panourile solare ale stației, de mărimea unui teren de fotbal. Un sistem similar ar putea fi folosit pe Lună.

ISS pe orbita Pământului
AstroCrops - Cultivarea plantelor pentru viitoarele misiuni spațiale
Scurtă descriere: În acest set de activități, elevii vor înțelege germinația și creșterea plantelor urmărind dezvoltarea a trei plante necunoscute.

Aterizarea pe Lună - Planificarea și proiectarea unui modul de aterizare pe Lună
Scurtă descriere: În acest set de activități, elevii vor planifica, proiecta și construi un modul de aterizare pentru a asigura supraviețuirea echipajului (în

Constituția Lunii - Cum ar fi organizată o viitoare comunitate lunară?
Scurtă descriere: În această resursă, elevii vor dezbate câteva caracteristici organizaționale și sociale ale unei viitoare așezări pe Lună și le vor pune în legătură cu