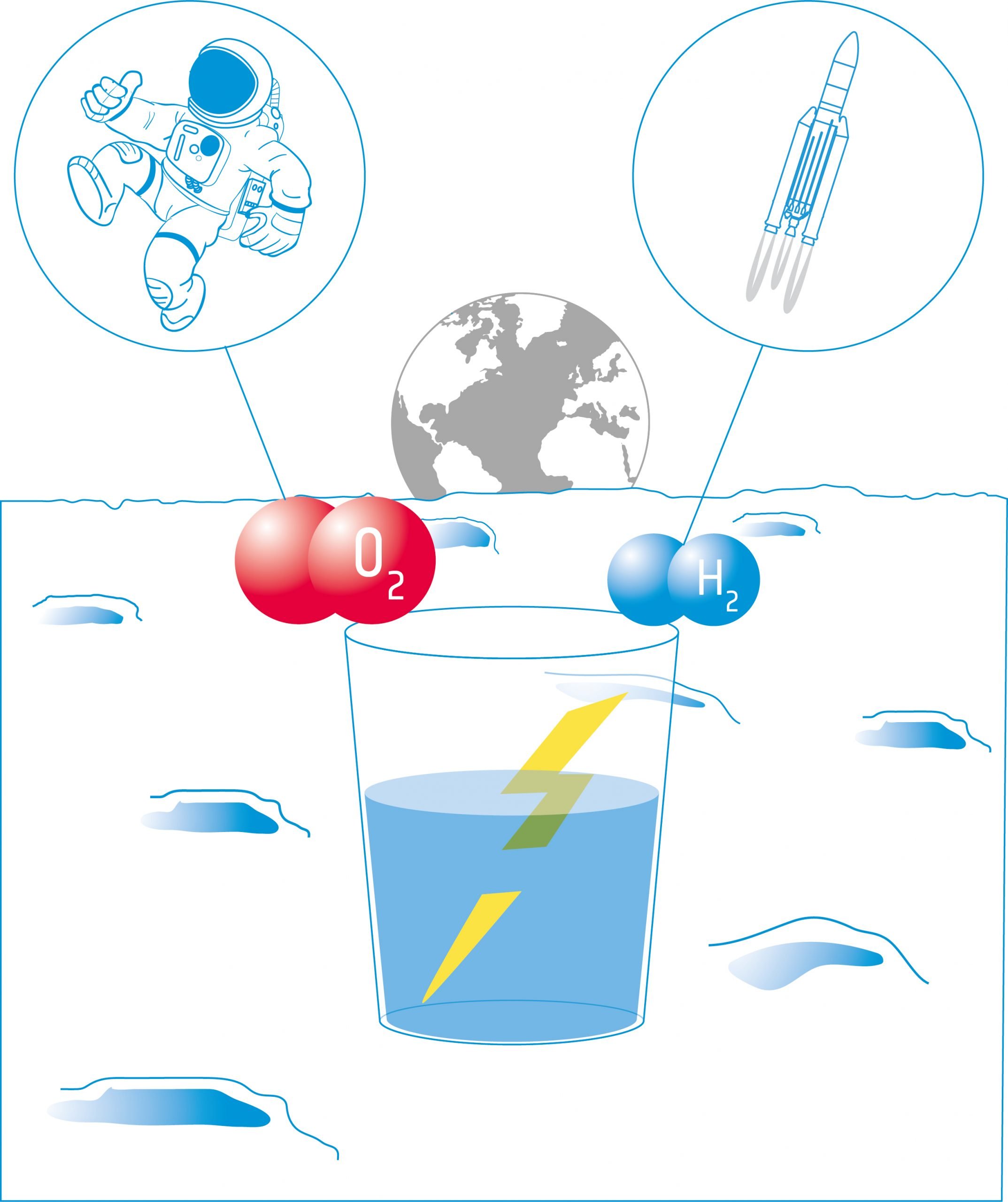
Energia da Água - Como produzir oxigénio e hidrogénio na Lua
Neste conjunto de três actividades, os estudantes aprenderão sobre electroquímica.
Na primeira actividade, irão construir uma pilha voltaica - uma bateria simples. Esta invenção marcou o início da electroquímica.
Os estudantes estudarão então a electrólise. A electrólise utiliza corrente eléctrica para dividir a água nos seus componentes: hidrogénio e oxigénio. Estes produtos podem ser utilizados como propulsores para naves espaciais e/ou para fornecer oxigénio para apoiar uma tripulação.
Na última actividade, os estudantes examinam e utilizam uma célula de combustível.
Objectivos de Aprendizagem
Faixa etária:
14 - 16 anos de idade
Hora
Preparação: 1 hora
Lição: 2 horas
Lição: 2 horas
Recurso disponível em:
Actividade 1: Construa a sua própria bateria
Nesta actividade, os estudantes construirão uma pilha voltaica - uma bateria simples - a partir de placas metálicas, pano de prato e vinagre. Uma pilha voltaica utiliza uma reacção química espontânea para criar electricidade.

Equipamento
Actividade 2: Electrólise
Nesta actividade, os estudantes construirão um electrolisador: um dispositivo que introduz uma corrente eléctrica num líquido utilizando dois eléctrodos. Utilizarão o dispositivo para a electrólise da água e descobrirão que é possível dividir a água nos seus componentes: oxigénio e hidrogénio.
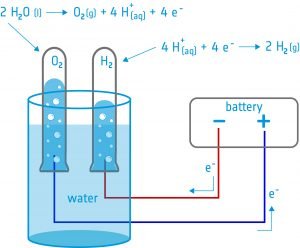
Equipamento
Actividade 3: Célula de combustível
Nesta actividade, os estudantes utilizarão os produtos da electrólise da água (H2 e O2) numa célula de combustível. Investigarão como as células de combustível produzem electricidade e calor a partir de uma reacção química. Os estudantes irão considerar as possibilidades e limitações das células de combustível para a exploração da Lua.
Equipamento
Sabia que...
A electrólise da água é o principal método de geração de oxigénio a bordo da Estação Espacial Internacional (ISS). A água é recolhida da urina, águas residuais e condensação e dividida em oxigénio e hidrogénio no Sistema de Geração de Oxigénio (OGS).
As matrizes solares do tamanho do campo de futebol da estação são a fonte de energia. Um sistema semelhante poderia ser utilizado na Lua.
As matrizes solares do tamanho do campo de futebol da estação são a fonte de energia. Um sistema semelhante poderia ser utilizado na Lua.

A ISS orbitando a Terra
Palavras-chave:
Mão biónica - Construir uma mão biónica
Breve descrição: Nesta actividade, os alunos irão construir uma mão biónica feita de cartão, cordas, palhinhas e elásticos. Relacionarão o biónico
3... 2...1... Levantem-se! - Construir o seu próprio foguetão de papel
Breve descrição: Neste conjunto de 3 actividades, os estudantes irão conceber e construir os seus próprios foguetes de papel e lançá-los. Aprenderão o que é
Extrair Água do Solo Lunar - Aprender sobre filtração e destilação
Breve descrição: Neste recurso, os estudantes aprenderão sobre as mudanças de estado da matéria utilizando a água na Lua como exemplo. Interpretarão