Energia dall'acqua - Come produrre ossigeno e idrogeno sulla Luna
In questa serie di tre attività, gli studenti impareranno a conoscere l'elettrochimica.
Nella prima attività, i ragazzi costruiranno una pila voltaica, una semplice batteria. Questa invenzione ha segnato l'inizio dell'elettrochimica.
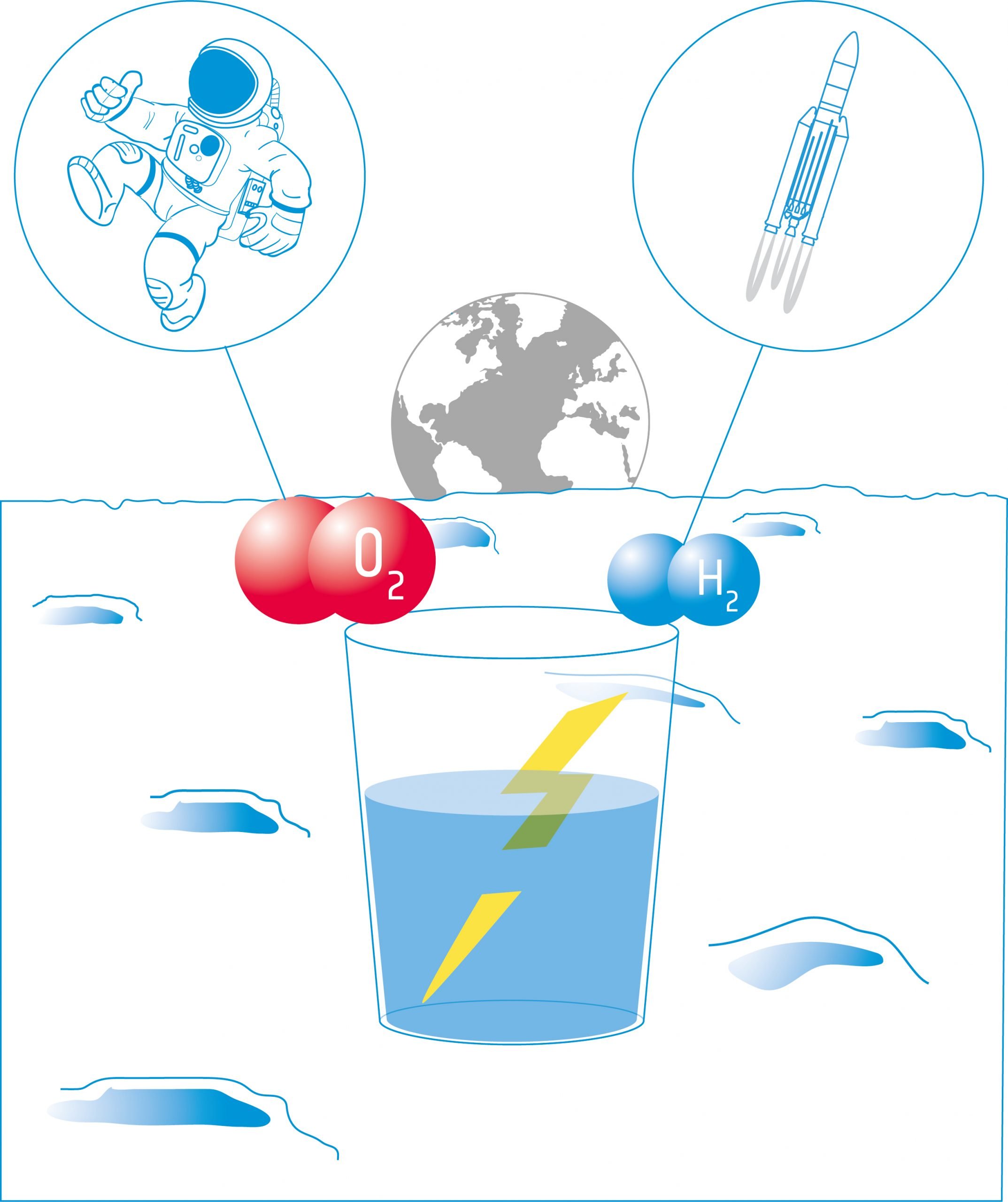
Gli studenti studieranno poi l'elettrolisi. L'elettrolisi utilizza la corrente elettrica per scindere l'acqua nei suoi componenti: idrogeno e ossigeno. Questi prodotti possono essere utilizzati come propellenti per i veicoli spaziali e/o per fornire ossigeno per l'equipaggio.
Nell'ultima attività, gli studenti esaminano e utilizzano una cella a combustibile.
Obiettivi di apprendimento
Fascia d'età:
14 - 16 anni
Tempo
Preparazione: 1 ora
Lezione: 2 ore
Lezione: 2 ore
Risorsa disponibile in:
Attività 1: costruire la propria batteria
In questa attività, gli studenti costruiranno una pila voltaica - una semplice batteria - a partire da piatti di metallo, strofinacci e aceto. Una pila voltaica utilizza una reazione chimica spontanea per creare elettricità.

Attrezzatura
Attività 2: Elettrolisi
In questa attività, gli studenti costruiranno un elettrolizzatore: un dispositivo che introduce una corrente elettrica in un liquido utilizzando due elettrodi. Utilizzeranno il dispositivo per l'elettrolisi dell'acqua e scopriranno che è possibile scindere l'acqua nei suoi componenti: ossigeno e idrogeno.
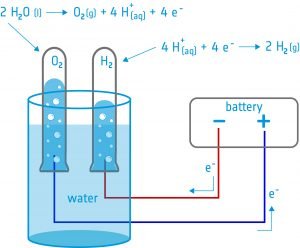
Attrezzatura
Attività 3: Cella a combustibile
In questa attività, gli studenti utilizzeranno i prodotti dell'elettrolisi dell'acqua (H2 e O2) in una cella a combustibile. Studieranno come le celle a combustibile producono elettricità e calore da una reazione chimica. Gli studenti considereranno le possibilità e i limiti delle celle a combustibile per l'esplorazione della Luna.
Attrezzatura
Lo sapevate?
L'elettrolisi dell'acqua è il metodo principale per generare ossigeno a bordo della Stazione Spaziale Internazionale (ISS). L'acqua viene raccolta dall'urina, dalle acque reflue e dalla condensa e scissa in ossigeno e idrogeno nel sistema di generazione dell'ossigeno (OGS).
La fonte di energia è costituita dai pannelli solari della stazione, grandi come un campo da calcio. Un sistema simile potrebbe essere utilizzato sulla Luna.
La fonte di energia è costituita dai pannelli solari della stazione, grandi come un campo da calcio. Un sistema simile potrebbe essere utilizzato sulla Luna.

La ISS in orbita intorno alla Terra
Parole chiave:
Insegnare con la luna
Pagina web dell'ESA Insegnare con la Luna. Una raccolta di risorse lunari per insegnanti ed educatori.

Atterrare sulla Luna - Pianificazione e progettazione di un lander lunare
Breve descrizione: In questa serie di attività, gli studenti pianificheranno, progetteranno e costruiranno un modulo di atterraggio per garantire la sopravvivenza dell'equipaggio (nel caso in cui il modulo di atterraggio non sia stato progettato).

Orsi spaziali - Esperienza di laboratorio con i tardigradi
Breve descrizione: In questa serie di attività sperimentali, gli studenti studieranno le capacità di sopravvivenza dei tardigradi, noti anche come orsi d'acqua. Esporranno le condizioni