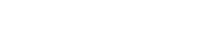Energie din apă - Cum să producem oxigen și hidrogen pe Lună
În acest set de trei activități, elevii vor învăța despre electrochimie.
În cadrul primei activități, vor construi o pilă voltaică - o baterie simplă. Această invenție a marcat începutul electrochimiei.
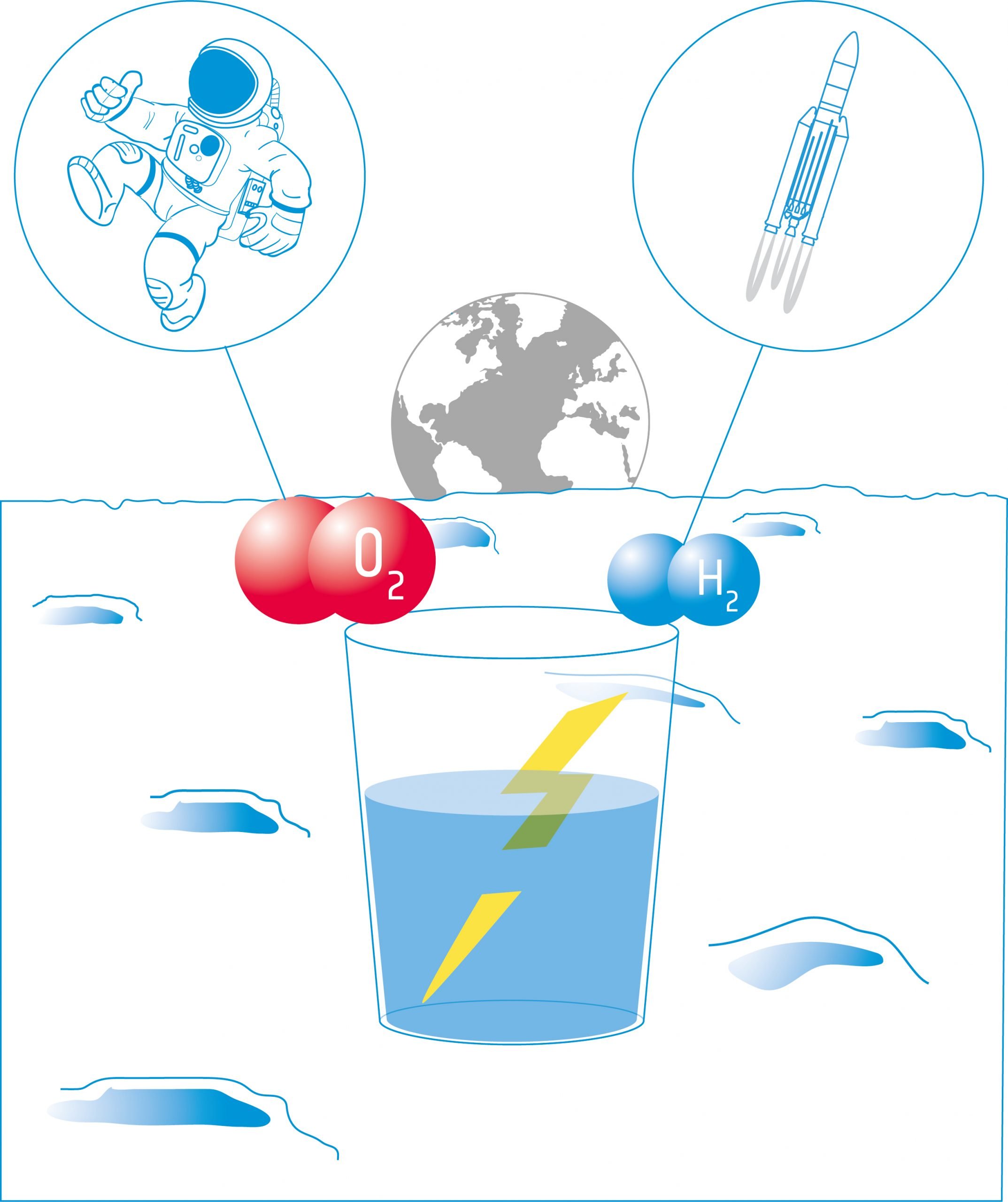
Elevii vor studia apoi electroliza. Electroliza utilizează curentul electric pentru a descompune apa în componentele sale: hidrogen și oxigen. Aceste produse pot fi folosite ca propulsoare pentru navele spațiale și/sau pentru a furniza oxigen pentru a susține un echipaj.
În ultima activitate, elevii examinează și utilizează o celulă de combustibil.
Obiective de învățare
Interval de vârstă:
14 - 16 ani
Timp
Pregătirea: 1 oră
Lecție: 2 ore
Lecție: 2 ore
Resurse disponibile în:
Activitatea 1: Construiește-ți propria baterie
În cadrul acestei activități, elevii vor construi o pilă voltaică - o baterie simplă - din plăci de metal, cârpă de vase și oțet. O pilă voltaică folosește o reacție chimică spontană pentru a crea electricitate.

Echipament
Activitatea 2: Electroliza
În această activitate, elevii vor construi un electrolizator: un dispozitiv care introduce un curent electric într-un lichid cu ajutorul a doi electrozi. Ei vor folosi dispozitivul pentru electroliza apei și vor descoperi că este posibil să scindeze apa în componentele sale: oxigen și hidrogen.
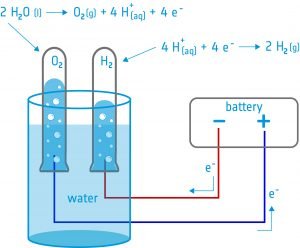
Echipament
Activitatea 3: Celula de combustibil
În această activitate, elevii vor folosi produsele electrolizei apei (H2 și O2) într-o celulă de combustibil. Aceștia vor studia modul în care pilele de combustie produc electricitate și căldură în urma unei reacții chimice. Elevii vor lua în considerare posibilitățile și limitele pilelor de combustie pentru explorarea Lunii.
Echipament
Știați că?
Electroliza apei este principala metodă de generare a oxigenului la bordul Stației Spațiale Internaționale (ISS). Apa este colectată din urină, ape reziduale și condensare și este împărțită în oxigen și hidrogen în sistemul de generare a oxigenului (OGS).
Sursa de energie este reprezentată de panourile solare ale stației, de mărimea unui teren de fotbal. Un sistem similar ar putea fi folosit pe Lună.
Sursa de energie este reprezentată de panourile solare ale stației, de mărimea unui teren de fotbal. Un sistem similar ar putea fi folosit pe Lună.

ISS pe orbita Pământului

AstroFood - Să învățăm despre plantele comestibile din spațiu
Scurtă descriere: În acest set de activități, elevii vor învăța despre diferitele componente ale plantelor. Ei vor învăța ce părți ale plantelor sunt comestibile

Space Bears - Experiența de laborator cu Tardigrade
Scurtă descriere: În acest set de activități experimentale, elevii vor investiga abilitățile de supraviețuire ale tardigradelor, cunoscute și sub numele de urși de apă. Ei vor expune condițiile

Apă pe Lună - Filtrarea nucleelor de gheață lunară pentru a extrage apa
Scurtă descriere: În această resursă, elevii vor petrece o zi înregistrând aproximativ câtă apă folosesc pentru diferite activități. Acest lucru este urmat de o