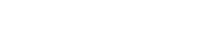Energía a partir del agua - Cómo producir oxígeno e hidrógeno en la Luna
En este conjunto de tres actividades, los alumnos aprenderán sobre la electroquímica.
En la primera actividad, construirán una pila voltaica, una batería sencilla. Este invento marcó el inicio de la electroquímica.
A continuación, los alumnos estudiarán la electrólisis. La electrólisis utiliza la corriente eléctrica para dividir el agua en sus componentes: hidrógeno y oxígeno. Estos productos pueden utilizarse como propulsores para las naves espaciales y/o para proporcionar oxígeno a la tripulación.
En la última actividad, los alumnos examinan y utilizan una pila de combustible.
Objetivos de aprendizaje
Rango de edad:
14 - 16 años
Tiempo
Preparación: 1 hora
Lección: 2 horas
Lección: 2 horas
Recurso disponible en:
Actividad 1: Construye tu propia batería
En esta actividad, los alumnos construirán una pila voltaica -una simple batería- con platos de metal, paños de cocina y vinagre. Una pila voltaica utiliza una reacción química espontánea para crear electricidad.

Equipo
Actividad 2: Electrólisis
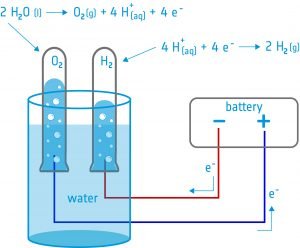
En esta actividad, los alumnos construirán un electrolizador: un dispositivo que introduce una corriente eléctrica en un líquido utilizando dos electrodos. Utilizarán el dispositivo para la electrólisis del agua y descubrirán que es posible dividir el agua en sus componentes: oxígeno e hidrógeno.
Equipo
Actividad 3: Pila de combustible
En esta actividad, los alumnos utilizarán los productos de la electrólisis del agua (H2 y O2) en una pila de combustible. Investigarán cómo las pilas de combustible producen electricidad y calor a partir de una reacción química. Los alumnos considerarán las posibilidades y limitaciones de las pilas de combustible para la exploración de la Luna.
Equipo
¿Lo sabías?
La electrólisis del agua es el principal método de generación de oxígeno a bordo de la Estación Espacial Internacional (ISS). El agua se recoge de la orina, las aguas residuales y la condensación y se divide en oxígeno e hidrógeno en el Sistema de Generación de Oxígeno (OGS).
Los paneles solares de la estación, del tamaño de un campo de fútbol, son la fuente de energía. Un sistema similar podría utilizarse en la Luna.
Los paneles solares de la estación, del tamaño de un campo de fútbol, son la fuente de energía. Un sistema similar podría utilizarse en la Luna.

La ISS orbita la Tierra
Palabras clave:

Kit de materiales para naves espaciales
Breve descripción: Los alumnos pueden utilizar el kit de materiales de la nave espacial de la ESA para investigar experimentalmente una variedad de materiales diferentes. Un conjunto de cinco actividades permite a los alumnos conseguir

AstroFood - Aprender sobre las plantas comestibles en el espacio
Breve descripción: En este conjunto de actividades, los alumnos conocerán los diferentes componentes de las plantas. Aprenderán qué partes de las plantas son comestibles

Refugio en la Luna - Investigando diferentes refugios en la Tierra y en el espacio
Breve descripción: En este conjunto de actividades, los alumnos analizarán la importancia de tener un refugio para protegerse en la Tierra y en el espacio. Los alumnos compararán