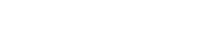L'énergie de l'eau - Comment produire de l'oxygène et de l'hydrogène sur la Lune ?
Dans cette série de trois activités, les élèves vont découvrir l'électrochimie.
Dans la première activité, ils construiront une pile voltaïque - une batterie simple. Cette invention a marqué le début de l'électrochimie.
Les élèves étudieront ensuite l'électrolyse. L'électrolyse utilise le courant électrique pour séparer l'eau en ses composants : l'hydrogène et l'oxygène. Ces produits peuvent être utilisés comme propulseurs pour les vaisseaux spatiaux et/ou pour fournir l'oxygène nécessaire à l'équipage.
Dans la dernière activité, les élèves examinent et utilisent une pile à combustible.
Objectifs d'apprentissage
Tranche d'âge :
14 - 16 ans
Temps
Préparation : 1 heure
Leçon : 2 heures
Leçon : 2 heures
Ressource disponible en :
Activité 1 : Construisez votre propre batterie
Dans cette activité, les élèves construiront une pile voltaïque - une batterie simple - à partir de plaques de métal, de linge à vaisselle et de vinaigre. Une pile voltaïque utilise une réaction chimique spontanée pour créer de l'électricité.

Équipement
Activité 2 : L'électrolyse
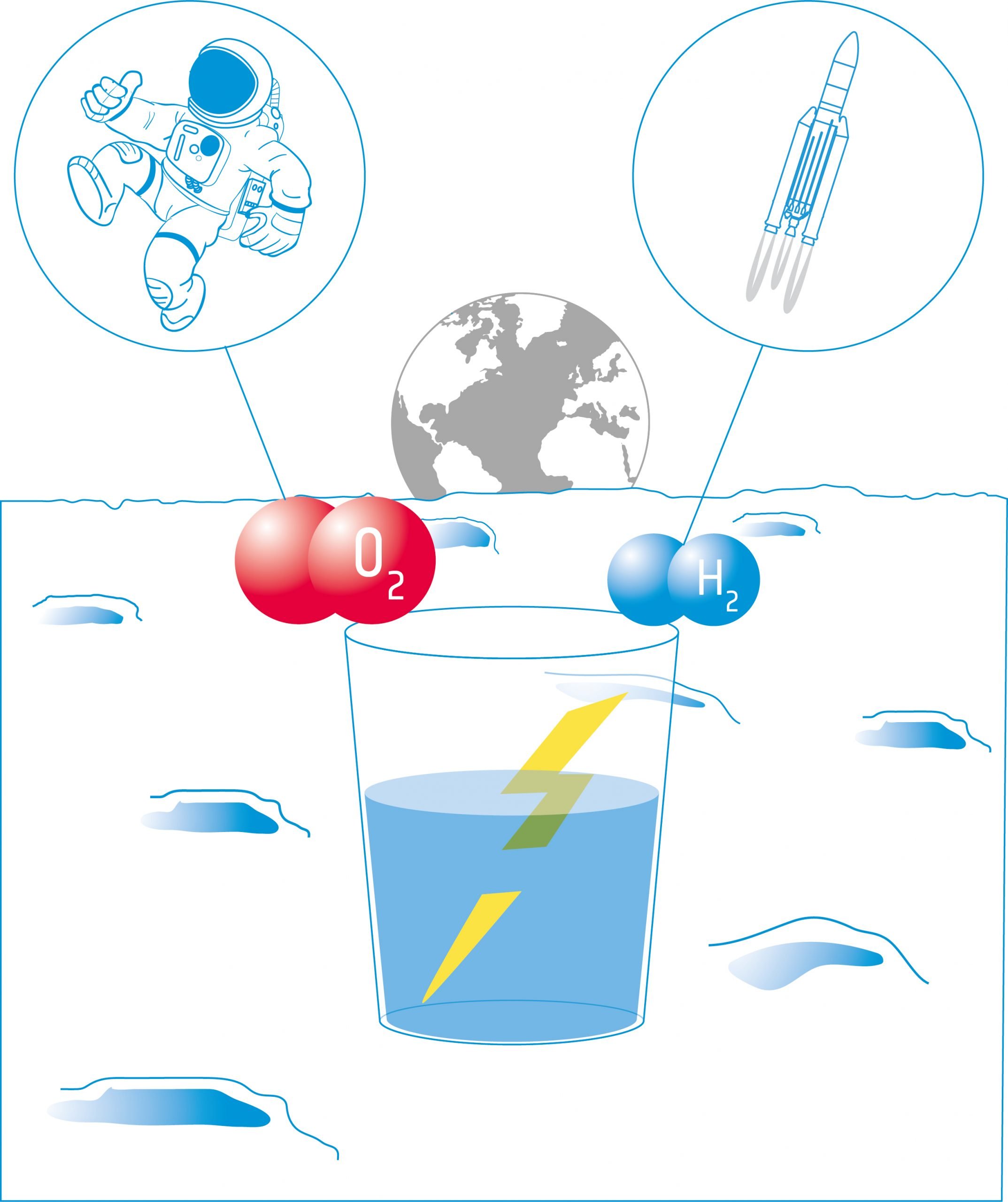
Dans cette activité, les élèves construiront un électrolyseur : un appareil qui introduit un courant électrique dans un liquide à l'aide de deux électrodes. Ils utiliseront l'appareil pour l'électrolyse de l'eau et découvriront qu'il est possible de séparer l'eau en ses composants : l'oxygène et l'hydrogène.
Équipement
Activité 3 : Pile à combustible
Dans cette activité, les élèves utiliseront les produits de l'électrolyse de l'eau (H2 et O2) dans une pile à combustible. Ils étudieront comment les piles à combustible produisent de l'électricité et de la chaleur à partir d'une réaction chimique. Les élèves examineront les possibilités et les limites des piles à combustible pour l'exploration de la Lune.
Équipement
Le saviez-vous ?
L'électrolyse de l'eau est la principale méthode de production d'oxygène à bord de la Station spatiale internationale (ISS). L'eau est recueillie à partir de l'urine, des eaux usées et de la condensation, puis divisée en oxygène et en hydrogène dans le système de génération d'oxygène (OGS).
Les panneaux solaires de la station, de la taille d'un terrain de football, constituent la source d'énergie. Un système similaire pourrait être utilisé sur la Lune.
Les panneaux solaires de la station, de la taille d'un terrain de football, constituent la source d'énergie. Un système similaire pourrait être utilisé sur la Lune.

L'ISS en orbite autour de la Terre
Mots-clés :

Bras robotique - Devenez ingénieur spatial pour un jour
Brève description : Dans cette activité, les élèves apprendront comment fonctionne leur bras et construiront un bras robotique inspiré de ce dernier. Les élèves comprendront les différents
L'énergie du soleil - L'énergie solaire au service de l'exploration spatiale
Brève description : Dans cette série d'activités, les élèves découvrent deux concepts qui influencent la conception des panneaux solaires pour les missions spatiales : la loi de l'inverse du carré.
Bionic Hand - Construction d'une main bionique
Brève description : Dans cette activité, les élèves construisent une main bionique à partir de carton, de ficelles, de pailles et d'élastiques. Ils associeront la main bionique