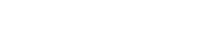Ūdens enerģija - kā ražot skābekli un ūdeņradi uz Mēness
Šajā trīs uzdevumu komplektā skolēni uzzinās par elektroķīmiju.
Pirmajā aktivitātē skolēni uzbūvēs voltāzu kaudzi - vienkāršu bateriju. Šis izgudrojums iezīmēja elektroķīmijas sākumu.
Pēc tam skolēni pētīs elektrolīzi. Elektrolīze izmanto elektrisko strāvu, lai sadalītu ūdeni tā sastāvdaļās: ūdeņradī un skābeklī. Šos produktus var izmantot kā degvielu kosmosa kuģiem un/vai lai nodrošinātu skābekli apkalpes uzturēšanai.
Pēdējā aktivitātē skolēni pēta un izmanto degvielas šūnu.
Mācību mērķi
Vecuma diapazons:
14 - 16 gadi
Laiks
Sagatavošana: 1 stunda
Nodarbība: 2 stundas
Nodarbība: 2 stundas
Resurss pieejams:
1. uzdevums: Izveido savu akumulatoru
Šajā aktivitātē skolēni no metāla plāksnēm, trauku lupatiņas un etiķa izveidos voltaja kaudzīti - vienkāršu bateriju. Voltaja baterija izmanto spontānu ķīmisku reakciju, lai radītu elektrību.

Aprīkojums
2. aktivitāte: elektrolīze
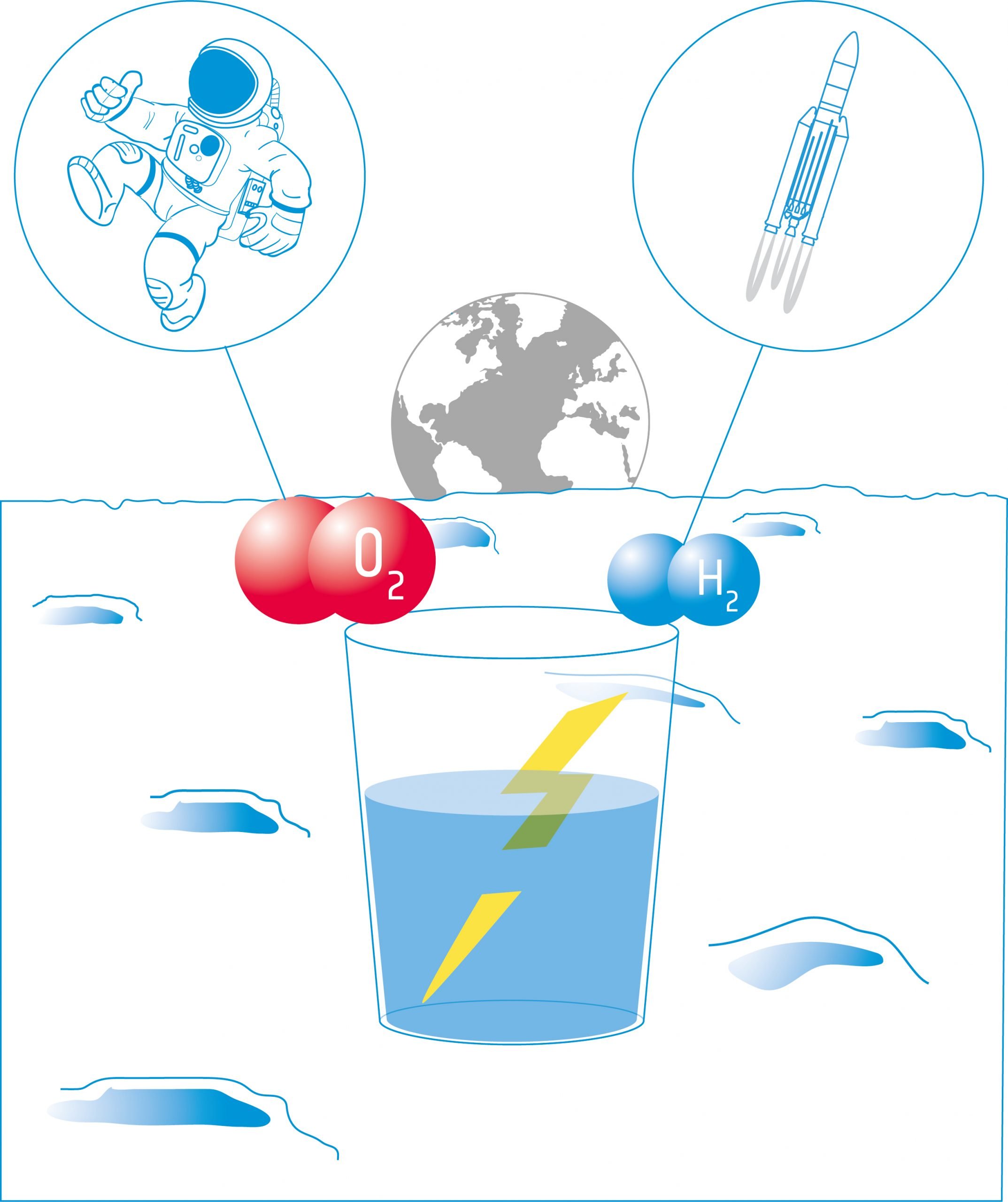
Šajā aktivitātē skolēni uzbūvēs elektrolīzeri - ierīci, kas ar divu elektrodu palīdzību šķidrumā ievada elektrisko strāvu. Viņi izmantos ierīci ūdens elektrolīzei un atklās, ka ūdeni ir iespējams sadalīt tā sastāvdaļās: skābeklī un ūdeņradī.
Aprīkojums
3. darbība: Degvielas elements
Šajā aktivitātē skolēni izmantos ūdens elektrolīzes produktus (H2 un O2) kurināmā elementā. Viņi pētīs, kā kurināmā elementi ķīmiskas reakcijas rezultātā ražo elektrību un siltumu. Skolēni apsvērs kurināmā elementu iespējas un ierobežojumus Mēness izpētē.
Aprīkojums
Vai zinājāt?
Ūdens elektrolīze ir galvenā skābekļa ražošanas metode Starptautiskajā kosmosa stacijā (SKS). Ūdens tiek savākts no urīna, notekūdeņiem un kondensāta, un skābekļa ģenerēšanas sistēmā (OGS) tas tiek sadalīts skābeklī un ūdeņradī.
Stacijas enerģijas avots ir futbola laukuma izmēra saules baterijas. Līdzīgu sistēmu varētu izmantot arī uz Mēness.
Stacijas enerģijas avots ir futbola laukuma izmēra saules baterijas. Līdzīgu sistēmu varētu izmantot arī uz Mēness.

SKS riņķo ap Zemi
Atslēgas vārdi:

AstroFarmer - Iepazīšanās ar augu augšanas apstākļiem
Īss apraksts: Šajā sešu uzdevumu kopumā skolēni pētīs, kādi faktori ietekmē augu augšanu, un saistīs šos faktorus ar augu audzēšanu kosmosā.

Mēness patversme - dažādu patversmju izpēte uz Zemes un kosmosā
Īss apraksts: Šajā aktivitāšu kopumā skolēni analizēs, cik svarīga ir patvēruma nozīme aizsardzībai uz Zemes un kosmosā. Skolēni salīdzinās
Enerģija no saules gaismas - kosmosa izpēte, izmantojot saules enerģiju
Īss apraksts: Šajā aktivitāšu kopumā skolēni uzzinās par diviem jēdzieniem, kas ietekmē saules paneļu konstrukciju kosmosa misijām: apgrieztais kvadrāta likums.